Equilibrios y Volumetrías (página 2)

Punto de equivalencia. El punto de equivalencia, o punto estequiométrico, de una reacción química es el punto en el que se han mezclado cantidades químicamente equivalentes de reactivos. Para una reacción ácido-base, el punto de equivalencia es donde los moles de ácido y los moles de base se neutralizarían entre sí según la reacción.
🧪VALORACIONES ACIDO DÉBIL Y BASE FUERTE Cálculo del pH en el punto de equivalencia YouTube

Titulaciones de ácido débil-base fuerte. Para la titulación de un ácido débil con una base fuerte, la curva de pH es inicialmente ácida y tiene un punto equivalencia básico (pH > 7). La sección de curva entre el punto inicial y el punto de equivalencia se conoce como región amortiguadora. En el punto de equivalencia media, las.
Punto De Equivalencia....

(c) Volumen de titulante = 25,00 mL. Esta adición de titulante implica una cantidad estequiométrica de base (el punto de equivalencia), por lo que solo los productos de la reacción de neutralización están en solución (agua y NaCl).Ni el catión ni el anión de esta sal sufren una ionización ácido-base; el único proceso que genera iones de hidronio es la autoprotólisis del agua.
Significado del punto de equivalencia en química Estimación YuBrain

Podríamos usar el naranja de metilo para la titulación de HCl, pero no nos daría resultados muy precisos: (1) Completa su cambio de color un poco antes de que se alcance el punto de equivalencia (pero muy cerca de él, por lo que esto no es demasiado serio); (2) cambia de color, como demuestra la Figura \(\PageIndex{2}\), durante la adición de casi 0.5 ml de NaOH, que no es un cambio de.
Formulas de Equivalencia YouTube

encontrando que el pH en el punto de equivalencia es de 8.79. Después del punto de equivalencia, el valorante está en exceso y la mezcla de titulación es una solución diluida de NaOH. Podemos calcular el pH usando la misma estrategia que en la titulación de un ácido fuerte con una base fuerte.
Qué es el punto de equivalencia en una titulación acido base En las reacciones ácidobase

El punto de equivalencia o punto estequiométrico de una reacción química se produce durante una valoración química cuando la cantidad de sustancia valorante agregada es estequiométricamente equivalente a la cantidad presente del analito o sustancia a analizar en la muestra, es decir reacciona exactamente con ella. En algunos casos, existen múltiples puntos de equivalencia que son.
+30 Ejemplos De Tablas De Equivalencias · Procrastina Fácil

El punto de equivalencia es el momento en el cual se ha completado la reacción química, mientras que el punto final es el momento en el cual se detecta un cambio en una propiedad física de la solución, como el color o el pH. El punto de equivalencia es más preciso y se determina utilizando indicadores de pH o métodos instrumentales. 3.
Cual Es Y Como Se Identifica El Punto De Equivalencia PDMREA
En una titulación ácido-base, el titulante es una base o ácido fuerte y, el analito es un ácido o base, respectivamente. El llamado punto de equivalencia en una titulación sucede cuando el titulante y el analito están presentes en cantidades estequimétricas. Este punto coincide cercanamente al final de la titulación, el cual puede ser.
Fórmulas de Volumetrías. Aplicando en principio del punto de equivalencia. YouTube

Detección del punto de equivalencia. Ya sea que el punto de equivalencia se revele o no por una "ruptura" distinta en la curva de titulación, corresponderá a una concentración única de iones de hidrógeno que se puede calcular de antemano. Existen muchas formas de determinar el punto de equivalencia de una titulación ácido-base.
Equilibrios y Volumetrías (página 2)

El punto de equivalencia , o punto estequiométrico , de una reacción química es el punto en el que se han mezclado cantidades químicamente equivalentes de reactivos. Para una reacción ácido-base, el punto de equivalencia es donde los moles de ácido y los moles de base se neutralizarían entre sí de acuerdo con la reacción química. Esto no implica necesariamente una relación molar 1:.
Determinacion De Pesos Equivalentes En Reacciones Quimicas Quimica Images

El punto de equivalencia es aquel en el que han reaccionado completamente dos sustancias químicas. En las reacciones ácido-base, este punto indica cuándo todo un ácido o una base ha sido neutralizado. Este concepto es cotidiano en las titulaciones o valoraciones volumétricas, y se determina mediante cálculos matemáticos simples..
PPT 7. Equilibrios ácidobase II PowerPoint Presentation, free download ID488675
El punto de equivalencia o punto estequiométrico de una reacción química se produce durante una valoración química cuando la cantidad de sustancia valorante agregada es estequiométricamente equivalente a la cantidad presente del analito o sustancia a analizar en la muestra, es decir reacciona exactamente con ella. [1] En algunos casos, existen múltiples puntos de equivalencia que son.
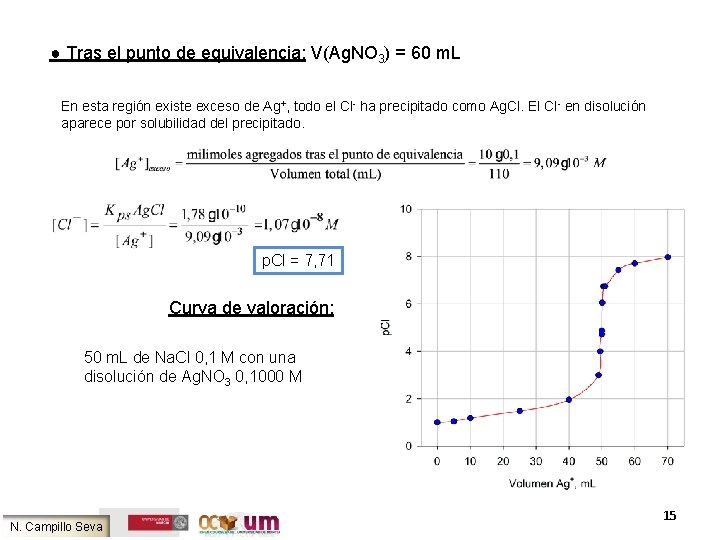
Asignatura Anlisis Qumico Grado Bioqumica Curso acadmico 201112
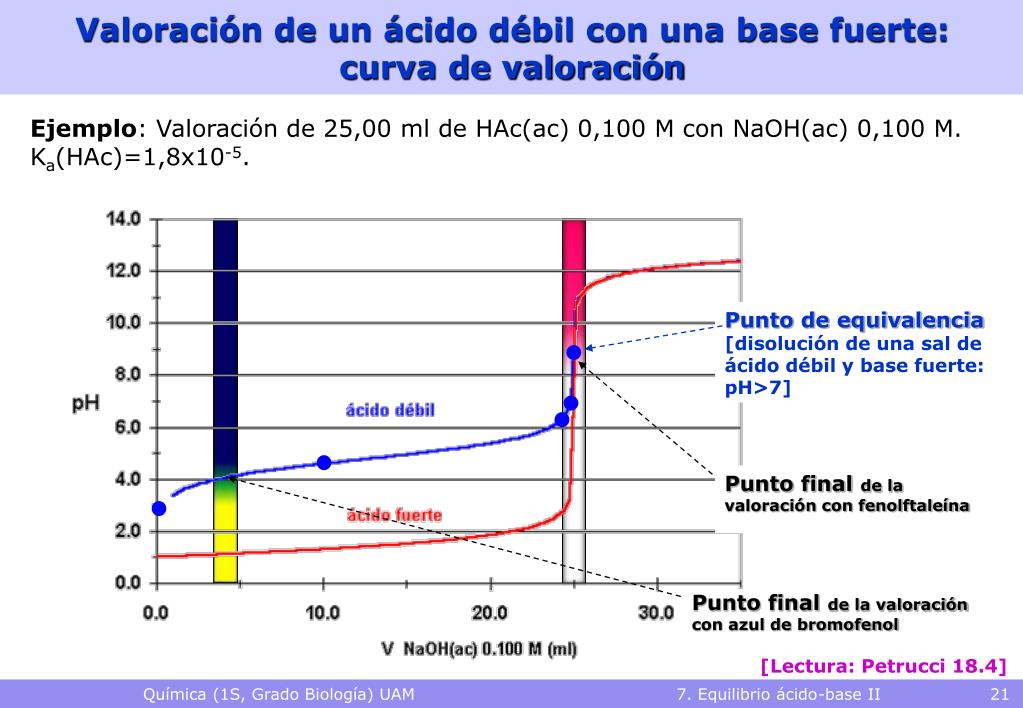
El pH de la solución cuando la reacción de NaOH y HCL alcanza el punto de equivalencia es 7. Figura. Curva de titulación. Esta curva muestra el aumento del nivel de pH durante la titulación de una solución de ácido fuerte con hidróxido de sodio (NaOH). El punto de equivalencia se alcanza en pH 7. El punto final se detecta en pH 8,2.
Punto de Equivalencia y Punto Final PDF Valoración Química

El punto de equivalencia o el punto estequiométrico es el punto en una reacción química cuando hay exactamente suficiente ácido y base para neutralizar la solución. en una titulación, es donde los moles de valorante son iguales a los moles de solución de concentración desconocida. la relación ácido / base no es necesariamente 1: 1.
Punto final y punto de equivalencia 2022 QUíMICA

El punto de equivalencia , o punto estequiométrico , de una reacción química es el punto en el que se han mezclado cantidades químicamente equivalentes de reactivos. Para una reacción ácido-base, el punto de equivalencia es donde los moles de ácido y los moles de base se neutralizarían entre sí de acuerdo con la reacción química. Esto no implica necesariamente una relación molar de.
Tabla de equivalencias

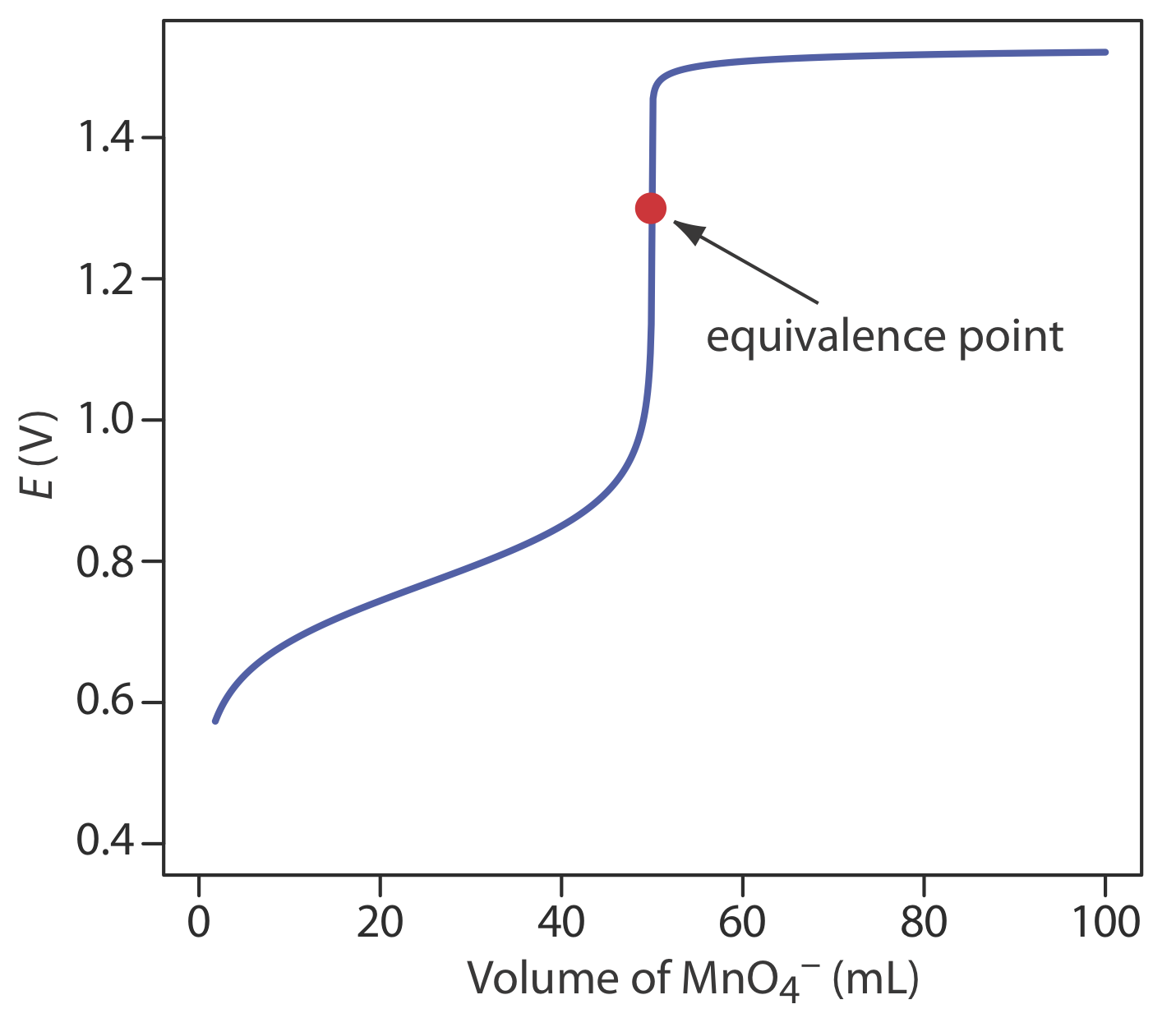
Tenga en cuenta que el punto de equivalencia de la titulación es asimétrico. Figura 9.4.3 . Curva de titulación para la titulación de 50.0 mL de 0.100 M Fe 2 + con 0.0200 M \(\text{MnO}_4^-\) a pH fijo de 1 (usando H 2 SO 4). El punto de equivalencia se muestra con el punto rojo.
.

